近期科学家在微生物组研究领域取得的重要研究成果!
来源:生物谷原创 2024-10-29 11:08
维生素D助力改变小鼠机体的肠道菌群从而赋予其更强的抗癌免疫力、自闭症和多动症等儿童神经发育障碍与幼年时肠道菌群紊乱有关、科学家识别出肠道菌群和兴奋性大脑信号之间的特殊分子关联
近年来,科学家们在肠道微生物组研究领域取得了多项重要研究成果,同时也发现了肠道微生物组与机体多个系统存在密不可分的关联,本文中,小编对相关研究成果进行整理,分享给大家!
【1】Science:维生素D助力改变小鼠机体的肠道菌群从而赋予其更强的抗癌免疫力
doi:10.1126/science.adh7954
如今研究人员已经揭示了维生素D在机体免疫调节和癌症发生中的关键作用,近日,一篇发表在国际杂志Science上题为“Vitamin D regulates microbiome-dependent cancer immunity”的研究报告中,来自Francis Crick研究所等机构的科学家们通过研究发现,维生素D或能促进小鼠机体中一种肠道细菌的生长,从而改善机体抵御癌症的免疫力。
图片来源:https://www.science.org/doi/10.1126/science.adh7954
研究揭示,维生素D通过促进一种名为脆弱拟杆菌的肠道益生菌增殖,为小鼠筑起了抗癌的微生物防线。这些幸运的小鼠在接受富含维生素D的食物后,展现出了更强的肿瘤抵抗能力,而人为降低其体内维生素D结合蛋白水平,也同样达到了这样的效果。
令人惊讶的是,研究人员发现,维生素D或能对肠道上皮细胞发挥作用,反过来增加一种名为脆弱拟杆菌(Bacteroides fragilis)的细菌的水平,这种微生物或能赋予小鼠抵御癌症更好的免疫力,因为其限制了所移植肿瘤的生长,但目前研究人员并不确定其背后的机制。为了检测是否这种细菌能单独赋予机体更好的抗癌免疫力,研究人员给正常饮食的小鼠注射了脆弱拟杆菌,这些小鼠就能更好地抵御肿瘤的生长,但当小鼠被置于维生素D缺乏的饮食中时,结果就会完全不同。
【2】Cell:新研究发现自闭症和多动症等儿童神经发育障碍与幼年时肠道菌群紊乱有关
doi:10.1016/j.cell.2024.02.035
近日,一篇发表在国际杂志Cell上题为“Infant microbes and metabolites point to childhood neurodevelopmental disorders”的研究报告中,来自美国佛罗里达大学等全球多个研究机构的科研团队揭示了婴幼儿时期肠道菌群失调与日后自闭症、多动症(ADHD)等神经发育障碍疾病的关联。
这项开创性的前瞻性研究着重考察了新生儿肠道菌群构成及其与其他多种影响儿童神经系统发育的因素间的关系。这些研究人员发现了许多似乎与未来神经系统发育障碍(如自闭症谱系障碍、多动症、交流障碍和智力障碍)有关的生物标志物。研究者Eric W Triplett表示,这项研究的难能可贵之处在于,这些生物标志物在孩子出生时就能在脐带血中发现,或者在孩子一岁时的粪便中发现,这比诊断结果早了十多年。
该研究是瑞典林雪平大学由Johnny Ludvigsson教授引领的ABIS(All Babies in Southeast Sweden, 即瑞典东南部所有婴儿)项目的一部分。研究团队对1997年至1999年间出生的逾16000名儿童进行了从出生直至他们二十多岁的长期追踪,这批儿童群体具有普遍代表性。在这些儿童中,有1197名儿童(约占7.3%)被诊断为自闭症谱系障碍、多动症、沟通障碍或智力障碍。通过对儿童成长过程中的多次采样调查,研究者们挖掘了大量的生活习惯和环境影响因素。
【3】Nat Cell Biol:科学家识别出肠道菌群和兴奋性大脑信号之间的特殊分子关联
doi:10.1038/s41556-023-01299-2
如今,越来越多的研究证据表明,肠道微生物群会影响机体大脑的功能和行为,然而肠道菌群调节宿主机体神经系统功能背后的分子机制,在很大程度上依然是未知的。近日,一篇发表在国际杂志Nature Cell Biology上题为“Vitamin B12 produced by gut bacteria modulates cholinergic signalling”的研究报告中,来自马萨诸塞大学医学院等机构的科学家们通过研究揭示了秀丽隐杆线虫机体肠道中产生维生素B12的特定细菌与乙酰胆碱(acetylcholine)产生之间的重要分子关联,乙酰胆碱是一种对机体记忆和认知功能非常重要的神经递质。
科学家识别出肠道菌群和兴奋性大脑信号之间的特殊分子关联
图片来源:Nature Cell Biology (2024). DOI:10.1038/s41556-023-01299-2
科学家们越来越多地认识到,饮食和肠道微生物可能在机体大脑健康中扮演着重要角色,肠道微生物组组成的改变或与多种神经系统疾病发生有关,比如焦虑、抑郁症、偏头痛和神经变性等;然而,梳理出单个细菌或营养物质对大脑功能的因果关系一直是一项巨大挑战。研究者Woo Kyu Kang说道,机体肠道中的细菌要比机体细胞多,大脑的复杂性,组成肠道微生物组的数百种细菌群落以及代谢产物的多样性几乎不太可能揭示细菌是如何影响机体大脑功能的。
为了分离出单一细菌对特定大脑功能的影响,研究人员给线虫喂食了一种由单一细菌所组成的饮食,这种细菌携带有特殊的突变,会导致大脑中的兴奋性/抑制性信号失衡,同时还会促使线虫出现癫痫样行为,人类中的类似遗传突变也会引起偏头痛。研究者Kang给这些突变的秀丽隐杆线虫喂食含有单一细菌群落的饮食,并观察其癫痫发作的频率,在所测试的40种不同的细菌饮食中,有18种饮食减少了线虫癫痫发作的次数,进一步实验结果表明,这些细菌的共同特征就是其都能产生维生素B12。
【4】Nat Cancer:特定的肠道菌群组合或能保护干细胞移植患者免于机体的免疫反应
doi:10.1038/s43018-023-00669-x
干细胞移植后,供体免疫细胞有时会攻击患者机体,这被称之为移植物抗宿主病(GvHD),近日,一篇发表在国际杂志Nature Cancer上题为“Bacteria and bacteriophage consortia are associated with protective intestinal metabolites in patients receiving stem cell transplantation”的研究报告中,来自慕尼黑工业大学等机构的科学家们通过研究发现,当肠道中存在某些微生物时,移植物抗宿主病的发病率或许要低得多,未来研究人员或许有望有意地引入这种微生物组的保护性组分。
干细胞移植能挽救诸如白血病等多种癌症患者的生命,然而,移植物抗宿主反应往往会发生在进行干细胞移植的一半患者中;从某种意义上来讲,其与器官捐献后的排斥反应相反,在排斥反应中机体会攻击所捐赠的器官,而在这里,所捐赠的细胞则会攻击机体组织,比如消化道。一段时间以来科学家们已经知道,肠道微生物在决定机体是否会发生移植物抗宿主病上扮演着重要角色,如今研究人员在这项研究中揭示了肠道微生物组或许在抵御移植物抗宿主病上发挥着重要功能。
文章中,研究人员分析了来自两所大学诊所中78名患者的粪便样本,并在其进行干细胞移植后对其追踪了2年多时间,研究人员利用这些结果开发了一种风险指数用来揭示机体出现排斥反应的可能性,研究人员并未对细菌进行计数,而是测定了微生物所产生的某些代谢产物的水平。这些免疫调节微生物代谢产物(IMMs)能影响机体的免疫系统和机体的再生能力,而值得注意的是,一种积极的预后并不仅仅取决于来自细菌的IMMs,研究者发现,肠道中的噬菌体或许也扮演着重要角色,仅凭这一点就为机体肠道微生物组的复杂世界提供了令人印象深刻的见解。
【5】JOR Spine:肠道微生物组或会影响机体的脊柱健康
doi:10.1002/jsp2.70005
你的肠胃会影响背部问题吗?近日,一篇发表在国际杂志JOR Spine上题为“Gut microbiome dysbiosis is associated with lumbar degenerative spondylolisthesis in symptomatic patients”的研究报告中,来自芝加哥拉什大学医疗中心等机构的科学家们通过研究发现,这两者之间或许存在某种关联。
文章中,研究人员观察了患有腰椎退行性椎体滑脱(lumbar degenerative spondylolisthesis, LDS)的患者和未患该病的个体,分析肠道微生物组对其脊柱健康产生的影响和差异。
研究者Dino Samartzis教授说道,有研究表明,脊柱的某些改变是由很多因素所引起的,我们都知道,这些改变与生活方式、肥胖、职业和遗传因素等因素有关,那么是否与肠道也有关呢?我们想通过研究观察相比未患腰椎退行性椎体滑脱的个体而言,腰椎退行性椎体滑脱患者机体肠道中是否会发生微生物组的任何改变,同时考虑我们过去所知道的可能会影响脊柱健康的传统因素。
【6】Cell Host & Microbe:功能失调的线粒体或会破坏肠道微生物组,从而引起克罗恩病的发生
doi:10.1016/j.chom.2024.06.013
线粒体功能的破坏会对克罗恩病产生根本性的影响,近日,一篇发表在国际杂志Cell Host & Microbe上题为“Mitochondrial perturbation in the intestine causes microbiota-dependent injury and gene signatures discriminative of inflammatory disease”的研究报告中,来自慕尼黑工业大学等机构的科学家们通过研究发现,功能异常的线粒体或会破坏肠道微生物组,进而诱发克罗恩病。
文章中,研究者发现,小鼠体内缺陷的线粒体会诱发慢性肠道炎症症状并影响肠道微生物组。克罗恩病(CD,Crohn’s disease)的典型症状包括慢性腹泻、腹痛和发烧,尽管目前研究人员并未完全阐明克罗恩病的病因,但多年来科学家们一直知道,肠道微生物组的改变与机体炎性疾病发生直接相关,一些研究人员认为,这些变化(其背后的原因目前尚不清楚)或许就是诱发克罗恩病的原因。
这项研究中,研究人员通过研究发现了微生物组改变的原因,同时他们还研究了微生物组、肠道上皮组织和线粒体之间的相互作用,肠道上皮组织是排列在肠道内部的一层细胞,其能帮助吸收营养物质并抵御病原体,线粒体则是细胞中能将营养物质转化为能量的特殊细胞器,因此其也会影响细胞代谢和细胞履行其功能的能力。研究者Dirk Haller及其同事一直在研究一种假设,即线粒体不仅能作为一种重要的细胞器,其还能与微生物组相互作用,此外,此前研究结果表明,慢性肠道炎症患者的肠道上皮组织会表现出一些指示线粒体可能存在功能障碍的特殊压力标志物。
【7】Gut Micro:肠道微生物组或会影响免疫细胞在机体中所处的位置
doi:10.1080/19490976.2024.2398126
肠道能在其长度上表现出明显的特征,而且其含有对维持机体健康至关重要的大量免疫细胞储存库和多种微生物群落。近日,一篇发表在国际杂志Gut Microbes上题为“Segmental patterning of microbiota and immune cells in the murine intestinal tract”的研究报告中,来自柏林大学夏瑞蒂医学院等机构的科学家们通过研究发现,小鼠机体胃肠道的不同解剖部分携带有不同的微生物群落组成,此外,微生物群落的特定组成也会影响任何特定区域的类型和丰度。

肠道微生物组或会影响免疫细胞在机体中所处的位置
图片来源:Gut Microbes, 16(1). doi:10.1080/19490976.2024.2398126.
文章中,研究人员绘制出了免疫细胞和微生物群落的复杂空间组织,从而就为研究肠道微生物与炎性肠病之间的相互作用提供了新的工具。此前研究结果表明,胃肠道中或许存在“热点”(hotspots)区域,其中特定的免疫细胞和微生物能更强烈地发生相互作用,研究者Hendrik Bartolomaeus博士说道,此前并没有研究人员系统性地研究机体整个肠道,我们的研究动机是一个简单的问题,即免疫细胞是如何沿着肠道组织进行组织排列的,而且微生物组是如何影响其组织的?
文章中,研究人员通过将小鼠的肠道组织解剖成几段,随后提取微生物DNA进行分析,从而比较了无菌小鼠和常规定植小鼠的胃肠道特性差异;他们还利用宏基因组测序技术来识别存在的所有细菌种类,同时他们还从这些组织片段中分离到了免疫细胞,并使用流式细胞计数对其进行分析,流式细胞计数技术是常用的基于特定细胞标记物的识别和量化不同免疫细胞类型的特殊技术。研究者发现,普通小鼠胃肠道中的微生物群落会因位置而异,这或许会显著影响肠道中免疫细胞的分布和类型,比如,在暴露于抗原(能在机体诱导免疫反应的外来物质)后获得的适应性免疫细胞在肠道的下端更为突出,而先天性免疫细胞则在肠道上端更为丰富,这种模式在无菌小鼠体内会受到严重干扰,因为无菌小鼠机体的肠道中缺少细菌抗原。
【8】Circ Heart Fail:科学家有望利用肠道微生物代谢产物TMAO来预测人类发生心力衰竭的风险
doi:10.1161/CIRCHEARTFAILURE.124.011569
如今,越来越多的研究证据表明,作为膳食胆碱和肉碱的肠道微生物代谢产物,三甲胺N-氧化物(TMAO,trimethylamine N-oxide)会增加机体心血管疾病和慢性肾脏疾病的风险;然而,目前研究人员并不清楚TMAO的循环浓度及其相关的膳食和肠道微生物衍生代谢产物(胆碱、甜菜碱、肉碱、γ-丁酰甜菜碱和巴豆甜菜碱)到底是如何影响机体偶发性心力衰竭(HF)的?
近日,一篇发表在国际杂志Circulation:Heart Failure上题为“Trimethylamine N -Oxide and Related Gut Microbe-Derived Metabolites and Incident Heart Failure Development in Community-Based Populations”的研究报告中,来自克利夫兰诊所等机构的科学家们通过研究发现,肠道微生物组中TMAO通路水平的升高或会导致机体心力衰竭的风险增加,而这独立于其它风险因素。
医学博士Stanley Hazen说道,当前的研究结果表明,即使在登记时明显健康的受试者,定期测量其机体血液中TMAO的水平或能帮助预测其在长期随访过程中发生心力衰竭的偶发性风险。如今越来越多的研究表明,肠道微生物TMAO通路与机体心血管疾病和代谢疾病有关,而其也有望作为后期开发新型医学疗法的潜在靶点。TMAO是一种特殊的代谢产物,当细菌消化红肉和其它动物产品中某些丰富的营养物质时就会产生TMAO,在过去十年里,研究者Hazen发表的大量研究都发现高水平的TMAO或与机体心血管疾病(包括诸如心脏病发作、中风等不良事件)和慢性肾脏疾病的发生风险增加有关。
【9】Nat Commun:特殊的肠道微生物通路或能作为改进人类心脏病疗法的潜在靶点
doi:10.1038/s41467-024-50855-3
近日,一篇发表在国际杂志Nature Communications上题为“Gut microbe-generated phenylacetylglutamine is an endogenous allosteric modulator of β2-adrenergic receptors”的研究报告中,来自克利夫兰诊所等机构的科学家们通过研究揭示了肠道微生物组如何与机体细胞相互作用来引起心血管疾病;文章中,研究者发现,由肠道菌群所产生的废物,随后在肝脏中被吸收从而形成的苯乙酰谷氨酰胺(PAG,phenylacetylglutamine),一旦进入机体循环,就会与心脏细胞上的β-2肾上腺素能受体以此前未发现的位置发生相互作用。
PAG能与β-2肾上腺素能受体相互作用从而影响心肌细胞收缩的力度,研究人员认为这一过程或许会导致心力衰竭,在临床前模型中,此前被认为与信号活性无关的β-2肾上腺素能受体的突变部分就会阻止PAG抑制受体的功能,此前研究人员通过研究发现,受试者机体中PAG循环水平的升高往往与其患心力衰竭的风险增加有关,且会导致心力衰竭患者的预后较差。他们还发现,肠道微生物的PAG信号通路与多种心力衰竭相关特征和心血管疾病风险存在和机制样的关联,新的研究发现或许能让研究人员更接近于治疗性地靶向作用这一通路从而开发出改进型疗法来治疗或预防心力衰竭。
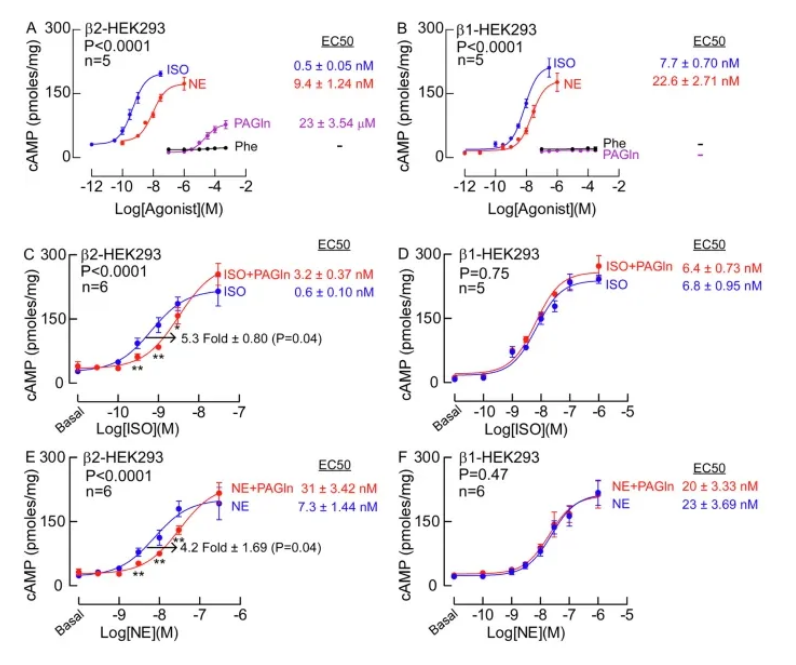
特殊的肠道微生物通路或能作为改进人类心脏病疗法的潜在靶点
图片来源:Nature Communications (2024). DOI:10.1038/s41467-024-50855-3
一种常用的治疗心力衰竭和血压的心脏药物就是能靶向作用机体“战斗或逃跑”反应的β阻滞剂,这种关键的反应是由β肾上腺素能受体所控制的,其是生存的基础,但随着时间推移,反复的“战斗或逃跑”反应就会导致机体心脏发生慢性损伤,从而导致心力衰竭发生。能减缓心脏压力的标准疗法就是使用β-阻滞剂药物,其能作为β-2肾上腺素能受体的开关,为了激活这种“战斗或逃跑”反应,诸如肾上腺素这样的激素就会直接与β-2肾上腺素能受体的定制槽结合,就好像钥匙滑进锁中一样。β-阻滞剂也能被设计成相同的锁孔,从而防止肾上腺素和其它激素与β-2肾上腺素能受体结合,这反过来就会导致心率减慢,从而减轻心脏的压力并能打开血管。
【10】Cell Host & Micro:纤维、基因和肠道微生物组?科学家揭示人类炎性肠病的潜在诱发因子
doi:10.1016/j.chom.2024.03.001
腹痛、腹泻、体重减轻,这些炎性肠病(IBD)的症状可能会给机体带来一定的破坏性并让机体衰弱。如今尽管科学家们已经阐明了炎性肠病存在一定的遗传成分,但并不是每个有疾病家族史的个体都会患上这种疾病,迄今为止,研究人员在很大程度上并不清楚引起克罗恩病和溃疡性结肠炎(统称为炎性肠病)的环境诱发因素。
近日,一篇发表在国际杂志Cell Host & Microbe上题为“Opposing diet,microbiome,and metabolite mechanisms regulate inflammatory bowel disease in a genetically susceptible host”的研究报告中,来自密歇根大学医学院等机构的研究人员通过研究发现了饮食、基因和肠道微生物之间复杂的相互作用,为解开IBD的发病之谜提供了崭新视角。这一最新研究建立在此前的研究基础之上,即低纤维饮食或会导致降解粘液的细菌不断增殖,这种细菌能通过摄入肠道粘膜内层进而繁殖。
对于某些个体而言,特别是那些白介素-10(IL-10)或其受体基因存在缺陷的婴幼儿和儿童,早发性炎性肠病的发生几率显著增加。为更深入剖析这一遗传关联,研究者选择了具有相似免疫异常的小鼠模型进行细致探究。尽管这些小鼠中部分会自发出现肠道炎症,但炎症程度各异,且在特定细菌存在和低纤维饮食的共同作用下,病情往往会进一步恶化。有趣的是,出生时肠道无菌的小鼠并未表现出患病迹象,暗示了微生物在IBD发病中的关键角色。
【11】Gut:揭示肠道微生物组或在人类慢性阻塞性肺病发生过程中扮演着关键角色
doi:10.1136/gutjnl-2023-330521
慢性阻塞性肺病(COPD,Chronic obstructive pulmonary disease)是全球人群患病和死亡的主要原因,最常见的原因就是吸烟;目前研究人员对其发病机制知之甚少,这就限制了有效疗法的开发,胃肠道微生物组能通过肠-肺轴参与到慢性肺部疾病的发生过程中,但其所扮演的关键角色,研究人员并不清楚。
近日,一篇发表在国际杂志Gut上题为“Faecal microbial transfer and complex carbohydrates mediate protection against COPD”的研究报告中,来自纽卡斯尔大学等机构的科学家们通过研究发现,肠道微生物组或在人类慢阻肺发生过程中扮演着重要角色,这就为开发新型疗法铺平了道路。
慢性肺部疾病是一种以呼吸困难为特征的人类疾病,慢阻肺是由长期吸烟或暴露于空气污染或其它毒性化合物中所引起的疾病,其是全球人群死亡的第三大原因。这项研究中,研究人员的主要发现包括识别出了与慢阻肺相关的不同肠道菌群,以及粪便微生物群移植(FMT)或能作为一种治疗慢阻肺的潜在有效疗法,此外,研究人员还发现,通过对肠道中所发现的微生物群落进行营养干预,慢阻肺患者或能取得良好的治疗预后。
研究者Phil Hansbro教授说道,肠道中拥有体内最大且最多样化的微生物组,根据其组成,其要么会诱发炎症,要么会抑制炎症,包括肺部炎症等。在研究人员所研究的小鼠模型中,他们识别出了与慢阻肺发生相关的特定肠道菌群,从而就证实了胃肠道微生物组、炎症和肺部疾病之间的复杂相互作用,研究人员还补充道,本文研究还阐明了粪便微生物移植或能有效治疗慢阻肺患者。
【12】PNAS:肠道微生物组或在人类社交焦虑症发生过程中扮演重要角色
doi:10.1073/pnas.2308706120
社交焦虑症(SAD,Social anxiety disorder)是一种严重的精神障碍,其主要特征是在社交场合中表现出强烈的恐惧或焦虑,以及对社交场合的回避;然而,目前研究人员并不清楚社交焦虑症发生背后的生物学机制,同时也需要更好的针对性治疗手段。最近,肠道微生物群已经成为了大脑和机体行为(尤其是与那些社会功能相关的行为)的关键调节子,此外,越来越多的研究数据都支持免疫功能和催产素信号在社会反应中的作用。
近日,一篇发表在国际杂志Proceedings of the National Academy of Sciences上题为“Social anxiety disorder-associated gut microbiota increases social fear”的研究报告中,来自爱尔兰国立科克大学等机构的科学家们通过研究发现,肠道生物群落中的某些微生物或许在机体社交焦虑症发生过程中扮演着重要角色,文章中,研究人员在小鼠机体中进行了粪便移植试验并测试了其机体的焦虑程度。
社交焦虑症是一种疾病,即当一个人在社交环境中与其他人接触,尤其是与其不认识的人接触时,其通常会经历比正常水平更高的焦虑症,诸如这种环境包括机会、参加课堂讨论,甚至是在杂货店门口排队等。此前研究结果表明,肠道微生物组的某些状况会对机体情绪产生一定得有影响,这或许就促使研究人员想通过研究确定是否肠道微生物组中的某些微生物在社交焦虑症中扮演着重要角色,为了找到答案,研究人员设计并对实验室小鼠进行了相关实验。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


